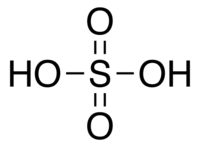
Ácido sulfúrico
O ácido sulfúrico, H2SO4, é um ácido mineral forte. É solúvel na água em qualquer concentração. O antigo nome do ácido sulfúrico era Zayt al-Zaj, ou óleo de vitríolo, cunhado pelo alquimista medieval iraniano Jabir ibn Hayyan (Geber), que também é o provável descobridor da substância. O ácido sulfúrico tem várias aplicações industriais e é produzido em quantidade maior do que qualquer outra substância (só perde em quantidade para a água). A produção mundial em 2001 foi de 165 milhões de toneladas, com um valor aproximado de 8 milhares de milhões (8 bilhões) de dólares. O principal uso engloba a fabricação de fertilizantes, o processamento de minérios, a síntese química, o processamento de efluentes líquidos e o refino de petróleo. Uma característica peculiar ao ácido sulfúrico é quanto ao seu comportamento relacionado à concentração. Quando diluído (abaixo de concentrações molares de 90%), a solução assume carácter de ácido forte e não apresenta poder desidratante. Por outro lado, quando é concentrado (acima de 90%), deixa de ter carácter ácido e acentua-se o seu poder desidratante.
Propriedades físicas
Embora possa ser feito ácido sulfúrico à concentração de 100%, tal solução perderia SO3 por evaporação, de maneira que restaria no final ácido sulfúrico a 98,3%. A solução a 98% é mais estável para a armazenagem e por isso é a forma usual do ácido sulfúrico "concentrado". Outras concentrações do ácido sulfúrico são usadas para diferentes fins:
- 33,5% : baterias ácidas (usado em baterias de chumbo-ácido)
- 62,18%: ácido de câmara ou ácido fertilizante
- 77,67%: ácido de torre ou ácido de Glover
- 98% : concentrado
O ácido sulfúrico também existe em diferentes purezas. O H2SO4 técnico é impuro e frequentemente colorido, mas é apropriado para a fabricação de fertilizante. O ácido sulfúrico de grau farmacêutico é usado para produzir fármacos e pigmentos.
Quando concentrações altas de SO3 (g) são adicionadas ao ácido sulfúrico, há formação de H2S2O7. O concentrado resultante é chamado de ácido sulfúrico fumegante ou oleum ou, menos comum, ácido de Nordhausen. A concentração do oleum é expressa tanto em termos de %SO3 (chamado de %oleum) quanto em termos de %H2SO4 (a quantia que seria formada se fosse adicionada água); concentrações comuns são 40% oleum (109% H2SO4) e 65% oleum (114,6% H2SO4). O H2S2O7 puro é de fato um sólido com ponto de fusão de
Polaridade e condutividade
O H2SO4 é um líquido muito polar, com uma constante dieléctrica de cerca de 100. Isto é pelo facto de o ácido sulfúrico ser capaz de dissociar-se e protonar-se, num processo conhecido como autoprotólise, que acontece a um grau 10 bilhões de vezes maior que na água.
Propriedades químicas
A reacção de hidratação do ácido sulfúrico é altamente exotérmica. Se a água for vertida sobre o ácido sulfúrico concentrado, poderá ferver e espirrar de forma perigosa. Deve-se sempre adicionar o ácido sobre a água e não o contrário. Como a hidratação do ácido sulfúrico é termodinamicamente favorável (ΔH = -880 kJ/mol), este ácido é um excelente agente desidratante. É usado para preparar diversas frutas secas. A afinidade do ácido sulfúrico por água é tanta que o ácido tomará átomos de hidrogénio e oxigénio de outros compostos; por exemplo, a mistura de amido (C6H12O6)n e ácido sulfúrico forma carbono elementar e água, que é absorvida pelo ácido. Pode-se ver tal reacção acontecer quando uma gota de ácido sulfúrico atinge uma folha de papel: no lugar onde a gota caiu, o papel fica com uma aparência de queimado
Usos
O ácido sulfúrico é uma commodity muito importante. Na verdade, a produção de ácido sulfúrico de uma nação é um bom indicador da sua força industrial. O principal uso (60% do total mundial) do ácido sulfúrico é na produção de ácido fosfórico por via húmida que, por sua vez, é usado na produção de fertilizantes fosfatados e de trifosfato de sódio, usado

0 Comments:
Post a Comment
<< Home